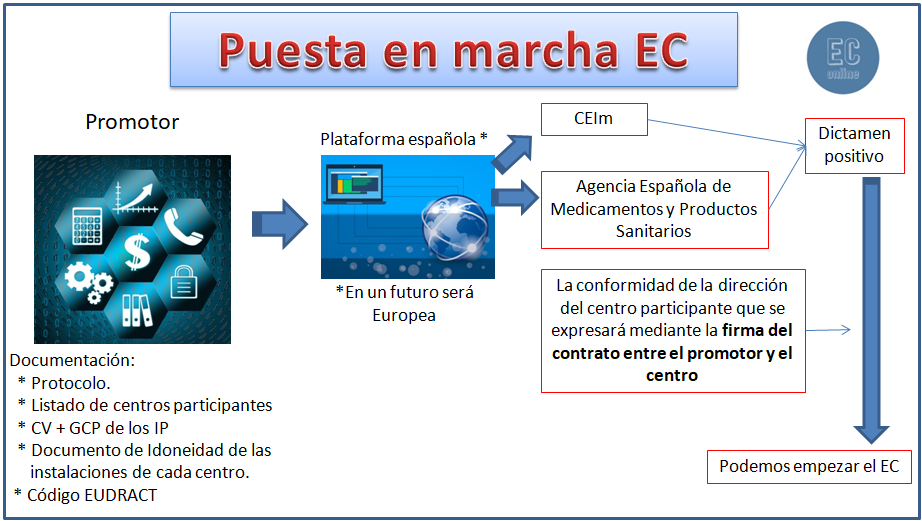
Para poder iniciar un ensayo clínico con medicamentos en un centro se precisará:
• El dictamen favorable emitido por un CEIm del territorio nacional conforme a lo indicado en el artículo 24 que será único y vinculante.
• La resolución de autorización de la Agencia Española de Medicamentos y Productos Sanitarios.
• La conformidad de la dirección del centro participante que se expresará mediante la firma del contrato entre el promotor y el centro al que se refiere el artículo 32. Este contrato podrá formalizarse en cualquier momento y será efectivo cuando el ensayo clínico sea autorizado por la Agencia Española de Medicamentos y Productos Sanitarios y disponga del dictamen favorable del CEIm para la realización del ensayo en dicho centro.
El promotor enviará simultáneamente la información necesaria a evaluar al CEIm y la AEMPS a través de un único portal europeo, que en este momento no funciona y que hasta que esté operativo se seguirá utilizando el portal de ensayos clínicos con medicamentos (ECM) de la AEMPS activo hasta ahora, con lo que las evaluaciones del CEIm y de la AEMPS están integradas en un mismo proceso. Ya no es necesario enviar la documentación en papel y tampoco CD, sino que todo el dossier de documentación se ha de enviar de forma electrónica a través del portal ECM de la AEMPS.