La fase III tiene por objetivo establecer el valor terapéutico del nuevo tratamiento, por comparación con un placebo y / o con tratamientos alternativos utilizados en las mismas indicaciones potenciales. Es decir, en la fase anterior ya tenemos la dosis adecuada, ahora miraremos la efectividad del tratamiento comparándolo con el tratamiento estándar.
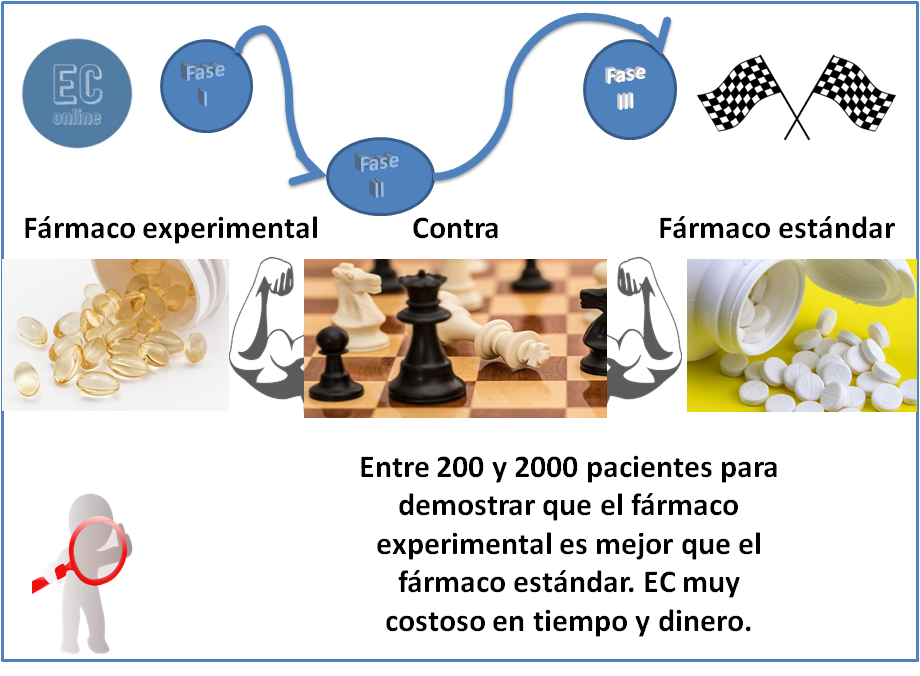
Esta fase no varía con respecto a los tratamientos oncológicos. Ya tenemos la dosis, sabemos que tiene actividad para esa patología, ahora nos queda demostrar que es más efectivo con relación a supervivencia que los pacientes tratados en la rama estándar.
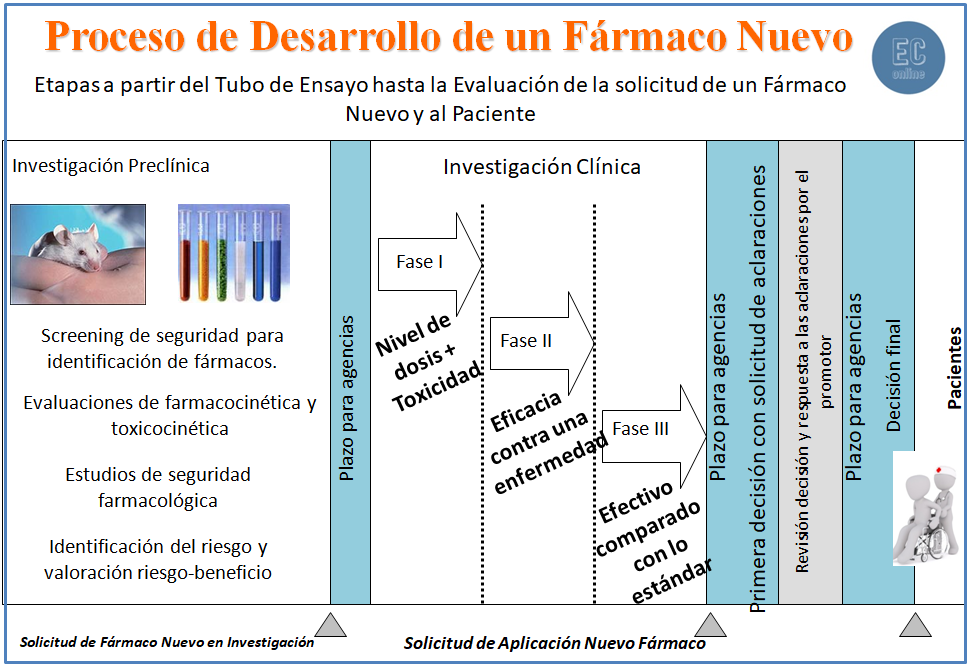
Una vez finalizadas estas tres fases (es normal necesitar más de un estudio confirmatorio en cada una de las fases), el promotor presenta una solicitud de registro del nuevo medicamento a las autoridades sanitarias.
Acelerar todo este proceso de demostrar la eficacia de un nuevo fármaco nos puede llevar a su retirada al poco tiempo de ser comercializado.
Esto es lo que pasó con el natalizumab, retirada del mercado tres meses después de la aprobación de su comercialización por la FDA de forma acelerada para el tratamiento de la esclerosis múltiple recidivante.
Esta aprobación se llevó a cabo a partir de datos a corto plazo (un año) de dos ensayos fase III, controlados con placebo, a doble ciego, aleatorizados y multicéntricos sobre el tratamiento de la enfermedad de Crohn y la esclerosis múltiple. No se publicó ningún ensayo en revistas con revisión por pares (peer review en inglés) y la FDA aprobó el producto antes de tener los datos del ensayo final y la información sobre la seguridad acumulada del fármaco, en los cuales después se confirmaron que tres pacientes desarrollaron leucoencefalopatía multifocal progresiva (incidencia de 1 caso por cada 1000) y dos de ellos fallecieron. Abhijit Chaudhuri. lecciones para ensayos clínicos del natalizumab en esclerosis múltiple (lessons for clinical trials from natalizumab in multiple sclerosis) BMJ 2006;332:416-419. (más información)
La aprobación del natalizumab y su retirada del mercado tres meses después cuestionan el proceso rápido de aprobación de la comercialización de nuevos fármacos y esta experiencia destaca los riesgos potenciales para los pacientes en los ensayos de fármacos nuevos, cuando el conocimiento de su eficacia, los resultados y la seguridad a largo plazo son desconocidos.
Y ahora…
La documentación de los diferentes Ensayos se presenta a las Agencias Regulatorias y se somete a una revisión exhaustiva para su aprobación. Si las agencias consideran que se necesita más evidencia que demuestre que los beneficios del nuevo tratamiento superan los riesgos, pueden que soliciten mayor información o incluso que se realicen más estudios.
Los medicamentos aprobados a menudo se mantienen bajo observación durante un largo tiempo mediante los estudios en fase IV. Con los estudios anteriores se demuestra un objetivo y los estudios fase IV servirán para confirmar este objetivo y otros como toxicidad tardía, respuesta en un subgrupo de población, estudios económicos,…